注射用ゾレドロン酸
適応症
悪性腫瘍の溶骨性骨転移による骨痛
臨床薬理学
ゾレドロン酸の薬理作用は主に骨吸収を阻害することであり、その作用メカニズムは完全には理解されておらず、さまざまな効果に関連している可能性があります。 ゾレドロン酸は、破骨細胞の活性を阻害し、破骨細胞のアポトーシスを誘導し、骨に結合することにより、石灰化した骨および軟骨の破骨細胞の吸収をブロックします。 ゾレドロン酸は、腫瘍によって放出される複数の刺激によって引き起こされる破骨細胞活性および骨カルシウム放出も阻害します。
使用量と投与量
点滴。 大人は毎回4mg、100mlの0.9%塩化ナトリウム注射または5%グルコース注射で希釈し、静脈内注入、注入時間は15分以上でなければなりません。 3〜4週間ごと、または医師の指示に従って投与してください。
処方
パウダーニードル
仕様書
4 mg(C5H10N2O7P2として計算)。
取扱説明書
承認日:2007年4月22日
改訂日:2014年8月29日
注射用ゾレドロン酸の説明書
指示を注意深く読み、医師の指導の下で使用してください。
[薬の名前]
一般名:注射用ゾレドロン酸
製品名:リダ
英語名: Zoledronic Acid for Injection
中国語ピンイン:Zhusheyong Zuolailinsuan
[成分]この製品の主成分はゾレドロン酸です。
化学名:[1-ヒドロキシ-2-(1-イミダゾリル)エチリデンジホスフェート一水和物。
化学構造:
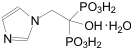
分子式:C5H10N2O7P2・H2O 分子量:290.1
【特性】本製品は白色またはオフホワイトのルースマスまたはパウダーです。
[効能]悪性腫瘍の溶骨性骨転移による骨痛。
[仕様] 4mg(C5H10N2O7P2に準拠)。
[用法および用量]点滴。大人は毎回4mg、100mlの0.9%塩化ナトリウム注射または5%グルコース注射で希釈し、静脈内注入、注入時間は15分以上でなければなりません。 3〜4週間ごと、または医師の指示に従って投与してください。
【副作用】
この製品の最も一般的な副作用は発熱であり、その他の副作用は主に次のとおりです。
全身反応:疲労、胸痛、下肢浮腫、結膜炎;
消化器系:吐き気、嘔吐、便秘、下痢、腹痛、嚥下困難、食欲不振;
心血管系:低血圧;
血液およびリンパ系:貧血、低カリウム血症、低マグネシウム血症、低リン血症、低カルシウム血症、好中球減少症、血小板減少症、全血細胞減少。
筋骨格:骨痛、関節痛、筋肉痛;
腎臓:血清中のクレアチニン値の上昇(投与時期に関連);
神経系:不眠、不安、興奮、頭痛、傾眠;
呼吸器系:呼吸困難、咳、胸水。
感染症:尿路感染症、上気道感染症;
代謝系:食欲不振、体重減少、脱水。
その他:インフルエンザのような症状、注射部位の発赤、発疹、かゆみなど。
ゾレドロン酸の毒性副作用はほとんど軽度で一時的なものであり、ほとんどの場合、特別な治療を行わなくても24〜48時間以内に自動的に解消します。
[タブー]
1.この製品および他のビスホスホネートにアレルギーのある障害のある患者。
2、重度の腎不全は推奨されません。
3.妊娠中の女性と授乳中の女性は禁止されています。
【注意事項】
1.初めてこの製品を使用するときは、カルシウム、リン、マグネシウム、血清クレアチニンの血清レベルを注意深く監視する必要がありますカルシウム、リン、マグネシウムの血清レベルが低すぎる場合は、必要な補足治療を行う必要があります。
2、悪性高カルシウム血症の患者は、本製品、利尿薬の投与前に十分に水分補給する必要があり、この製品は適切な水分補給後にのみ使用できます。この製品は腎毒性のある薬剤とともに使用する必要があります。
3.この製品を受け取ったときに、腎機能の悪化がある場合、腎機能がベースラインレベルに戻るまで薬を中止する必要があります。
4.この製品は、アスピリンにアレルギーのある喘息患者に注意して使用する必要があります。
[妊娠中の女性と授乳中の女性]
この製品は長期間骨と組み合わせることができるため、この製品が牛乳に分泌されるかどうかは明らかではありません。妊婦と授乳中の女性はこの製品を無効にします。
[子供の薬]
この製品の子供に対する安全性と有効性は確立されておらず、使用を推奨していません。
[老人用]
大人と一緒に使用します。しかし、高齢の患者は腎機能が低いことが多いため、薬物投与中は腎機能を注意深く監視する必要があります。
[薬物相互作用]
この製品はアミノグリコシドと組み合わせて使用する必要があります。アミノグリコシドは血中カルシウムを低下させる相乗効果があり、低カルシウム血症の期間を延長する可能性があります。利尿薬と組み合わせると、低カルシウム血症のリスクが高まる可能性があります。サリドマイドと組み合わせると、多発性骨髄腫患者の腎機能障害のリスクが高まります。
【薬物の過剰摂取】
この製品を大量に服用している患者は、血清中のカルシウム、リン、マグネシウムのレベルが低すぎる可能性があり、グルコン酸カルシウム、リン酸カリウムまたはナトリウム、硫酸マグネシウムの静脈内投与で補うことができます。さらに、この製品の高用量は腎毒性のリスクを高めます。ゾレドロン酸の単回投与量は4 mgを超えてはなりません。
【薬理学と毒性学】
薬理作用
ゾレドロン酸の薬理作用は主に骨吸収を阻害することであり、その作用メカニズムは完全には理解されておらず、さまざまな効果に関連している可能性があります。ゾレドロン酸は、破骨細胞の活性を阻害し、破骨細胞のアポトーシスを誘導し、骨に結合することにより、石灰化した骨および軟骨の破骨細胞の吸収をブロックします。ゾレドロン酸は、腫瘍によって放出される複数の刺激によって引き起こされる破骨細胞活性および骨カルシウム放出も阻害します。
毒性研究
遺伝毒性:
製品のエイムス細菌復帰突然変異試験、チャイニーズハムスター卵巣細胞染色体異常試験、チャイニーズハムスター遺伝子突然変異試験およびラット小核試験の結果は陰性でした。
生殖毒性:
雌ラットには、交配前の15日目から0.01、0.03、または0.1 mg / kg /日(4 mgのAUC 0.07、0.2および1.2倍の静脈内投与)を妊娠の終わりまで皮下注射しました。受胎率が低下します。中用量群と高用量群では、着床前の胚の損失が増加し、着床した胚の数と生きた胎児の数が減少し、新生ラットの生存率が低下しました。赤痢および周産期死亡率は、母親のすべての用量群で増加しました。母親の死因は、ビスフォスフォネートの一般的な役割である可能性のある周産期の低カルシウム血症につながる、骨カルシウム動員の薬物の阻害に関連している可能性があります。
雌ラットに0.1、0.2または0.4 mg / kg /日を皮下注射し(4 mgを静脈内投与した場合、AUC 1.2、2.4または4.8回)、中用量および高用量の動物に移植前または移植後を行いました。損失の増加、出生数の減少、胎児の骨、内臓および外観の奇形。高用量動物の同腹児の骨格奇形は、骨化および骨化、骨肥厚、屈曲または短縮を示さなかった。高用量群では、水晶体収縮、小脳低形成、肝小葉の収縮または喪失、肺葉の変形、血管拡張、口蓋裂、浮腫などの毒性反応もありました。骨格奇形は、低用量動物でも発生します。この試験では、高用量群の母動物は体重と摂餌量の減少を示し、試験が最高の薬物曝露レベルに達したことを示唆しています。
妊娠ウサギに0.01、0.03、0.1 mg / kg /日を皮下投与し(AUCは静脈内4 mgの0.5倍以下でした)、同腹筋に対する製品の毒性は観察されませんでした。各薬物群の動物で母体の死亡と流産が発生しました(相対体表面積に換算され、用量はヒト静脈内薬物4 mgの用量の0.05倍以上でした)。この現象は薬物による低カルシウム血症に関連している可能性があります。
発がん性:
従来の生涯にわたる発がん性試験は、マウスとラットを使用して実施されました。マウスに0.1、0.5、2.0 mg / kg /日を経口投与しました(相対的な体表面積に応じて、用量はヒト静脈内薬物4 mgの量の0.002倍以上でした)。また、グループ内のすべての動物はハーデル腺腫でした。発生率は増加しています。ラットに0.1、0.5、2.0 mg / kg /日を経口投与しました(相対体表面積に応じて、用量はヒト静脈内薬物4mgの量の0.2倍以下でした)、腫瘍発生率の増加はありませんでした
[薬物動態]
配布
がんおよび骨転移のある患者64人に2、4、8または16mgの単回投与または複数回投与(28日間で4回)を行い、注入時間は5または15分でした。点滴後に血漿中のゾレドロン酸濃度は低下しました。三相除去プロセスでは、滴濃度はピーク濃度値から急速に減少し、血中薬物濃度は24時間後にCmaxの1%未満になります。最初の2つの相の半減期はt1 /2αで0.25時間、t1 /2βで1.87時間でしたが、ゾレドロン酸の最終相はより長い時間にわたって除去され、点滴後2〜28日間は血漿中に低濃度のままでした。最終排出半減期t1 /2γは146時間で、血漿中の薬物濃度-時間曲線下面積(AUC0-24h)は、2〜16 mgの範囲で投与された用量に比例しました。 3相におけるゾレドロン酸の蓄積率は低く、2相3の平均AUC0-24h値の第1相に対する比は、それぞれ1.13±0.30および1.16±0.36でした。生体内および生体外の試験は、ゾレドロン酸のヒト血液細胞への親和性が低く、ヒト血漿タンパク質への結合率が約22%であり、結合率が濃度に依存しないことを示した。
2.代謝
in vitro試験では、ゾレドロン酸はヒトP450酵素に対する阻害効果がなく、ゾレドロン酸は生体内で生体内変換されず、主に腎臓から元の形で排泄されることが示されました。
排泄
ゾレドロン酸投与後24時間以内の64人の患者の尿の平均回収率は39±16%で、投与後2日目には微量の薬物しか尿中に検出されず、尿は0-24時間以内に投与されました。累積排泄率は、薬物の濃度とは関係ありません。尿中の薬物回収は、0〜24時間以内に平衡に達しません。薬物は最初に骨に結合し、その後ゆっくりと全身循環に放出されるため、観察される長期血漿は非常に長くなります。薬物の低濃度の現象。ゾレドロン酸の腎排泄率は、投与後0〜24時間以内に3.7±2.0 L / hであり、ゾレドロン酸のクリアランスは用量依存的であり、クレアチニンクリアランスに依存していた。ある研究では、癌および骨転移のある患者におけるゾレドロン酸4 mgの注入時間が5分(n = 5)から15分(n = 7)に延長され、点滴の終わりにゾレドロン酸が濃縮されました。前年比34%の減少([平均±SD] 403±118 ng / ml対264±86 ng / ml)、AUC合計値は10%増加(378±116 ng×h / ml対420±218 ng×h / ml) AUC値の差は統計的に有意ではありませんでした。
[保管]密封して保管します。
[パッケージ]バイアル、1ボトル/箱。
[有効期間] 18か月。
[実行基準]米国食品医薬品局国家医薬品規格YBH21602004-2014Z
[承認番号] National Drug Standard H20041979
[メーカー]
会社名:山東新タイムズ製薬株式会社
生産住所:山東省飛仙県北外輪1号
郵便番号:273400
電話番号:0539-8336336(販売)5030608(品質管理部)
ファックス番号:0539-5030900
ウェブサイト:www.LUNAN.com.cn
24時間対応のカスタマーサービスホットライン:400-0539-310