モンテルカストナトリウム錠
適応症
この製品は、昼夜の喘息症状の予防、アスピリンに敏感な喘息患者の治療、運動誘発性気管支収縮の予防など、15歳以上の成人の喘息の予防と長期治療を目的としています。この製品は、アレルギー性鼻炎(15歳以上の成人の季節性アレルギー性鼻炎および通年性アレルギー性鼻炎)によって引き起こされる症状の緩和に適しています。
臨床薬理学
モンテルカストナトリウムは、喘息の炎症を大幅に改善する強力な経口製剤です。生化学的および薬理学的バイオアッセイにより、モンテルカストはI型システイニルロイコトリエン(CysLT1)受容体(他の薬理学的に重要な気道受容体)に対して高い親和性と選択性を示しますプロスタグランジン、コリン作動性およびβアドレナリン受容体など)。モンテルカストは、LTC4、LTD4およびLTE4がCysLT1受容体に結合することによって生じる生理作用を、受容体アゴニスト活性なしで効果的に阻害できます。現在の研究では、モンテルカストはCysLT2受容体に拮抗しないことが示唆されています。
使用法と投与量
喘息および/またはアレルギー性鼻炎を患う15歳以上の患者は、1日1回、1錠ずつ(10 mg)。喘息患者は就寝前に服用する必要があります。季節性アレルギー性鼻炎の患者は、自分の状態に応じて必要なときに薬を服用できます。喘息とアレルギー性鼻炎の両方がある患者は、1晩に1回投与する必要があります。
処方
タブレット
仕様書
10mg(モンテルカストによる)。
取扱説明書
承認日:2008年5月13日
改訂日:2008年7月29日
2014年1月6日2016-4-21
モンテルカストナトリウム錠の指示
指示を注意深く読み、医師の指導の下で使用してください。
[薬の名前]
通称:モンテルカストナトリウム錠
英語名:Montelukast Sodium Tablets
中国語ピンイン: Menglusitena Pian
成分]この製品の主な成分は、モンテルカストナトリウムです。
化学名:[R-(E)]-1-[[[1- [3- [2-(7-クロロ-2-キノリン)ビニル]フェニル] -3- [2-(1-ヒドロキシ) 1-メチルエチル)フェニル]プロピル]チオ]メチル]シクロプロパン酢酸ナトリウム。
化学構造:
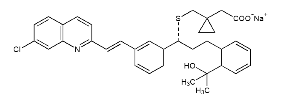
分子式:C35H35ClNNaO3S 分子量:608.17
[特性]この製品は黄色のフィルムコーティングタブレットで、フィルムコートを除去すると白色またはオフホワイトになります。
[適応]
この製品は、昼夜の喘息症状の予防、アスピリンに敏感な喘息患者の治療、運動誘発性気管支収縮の予防など、15歳以上の成人の喘息の予防と長期治療を目的としています。
この製品は、アレルギー性鼻炎(15歳以上の成人の季節性アレルギー性鼻炎および通年性アレルギー性鼻炎)によって引き起こされる症状の緩和に適しています。
[仕様] 10mg(Montelustによる)。
[用法・用量]
喘息および/またはアレルギー性鼻炎を患う15歳以上の患者は、1日1回、1錠ずつ(10 mg)。喘息患者は就寝前に服用する必要があります。季節性アレルギー性鼻炎の患者は、自分の状態に応じて必要なときに薬を服用できます。
喘息とアレルギー性鼻炎の両方がある患者は、1晩に1回投与する必要があります。
一般的なアドバイス
治療効果は喘息コントロール指数によって評価され、製品の有効性は薬物投与の1日以内に現れました。この製品は、食物と一緒に摂取するか、個別に提供することができます。喘息のコントロールや悪化に関係なく、患者は服用することをお勧めします。
高齢患者、腎不全患者、軽度から中等度の肝障害患者、性別の異なる患者は、用量を調整する必要はありません。
モンテルカストナトリウム錠と他の喘息治療薬の関係
この製品は、患者の既存の治療計画に追加できます。
併用薬の用量を減らす:
気管支拡張剤:
気管支拡張薬単独では効果的に制御できない喘息患者では、この製品を治療計画に追加することができます。臨床反応が出ると(通常は初回投与後)、気管支拡張薬の投与量は患者の許容範囲に応じて減らすことができます。 。
吸入コルチコステロイド:
吸入コルチコステロイドで治療されている喘息患者の場合、コルチコステロイドの投与量は、患者の耐性に応じて適切に減らすことができます。医学的監督の下で徐々に減らす必要があります。一部の患者は、吸入コルチコステロイドが完全に中止されるまで、量を徐々に減らすことができます。ただし、この製品は、吸入したコルチコステロイドを突然置き換えるため、または医師の指示に従って使用しないでください。
【副作用】
この製品は一般に忍容性が高く、軽度の副作用があり、通常は治療を終了する必要はありません。副作用の全体的な発生率はプラセボと同様でした。
15歳以上の喘息患者
この製品の安全性を評価するために、15歳以上の約2,600人の成人喘息患者を対象に臨床研究が行われています。同様に設計された2つの12週間のプラセボ対照臨床試験では、治療群の薬物関連発生率は1%以上であり、プラセボ群の有害事象は腹痛と頭痛でした。ただし、これらの有害事象の発生率は2つのグループ間で有意差はありませんでした。
臨床研究では、544人の患者がこの製品で少なくとも6か月間、253人の患者が1年間、21人の患者が2年間蓄積しています。この製品による治療時間の延長により、有害事象の発生は変化しませんでした。
15歳以上の季節性アレルギー性鼻炎患者
この製品の安全性を評価するために、15歳以上の季節性アレルギー性鼻炎の成人患者2199人を対象に臨床研究が実施されています。この製品を1日1回または夜に1回服用することは忍容性が高く、副作用の発生率はプラセボを服用することに似ています。プラセボ対照臨床試験では、薬物関連の発生率は、治療群で1%以上であり、プラセボ群よりも高いことはありませんでした。 4週間のプラセボ対照臨床試験では、安全性プロファイルは2週間の臨床試験と一致していました。すべての臨床研究で、嗜眠の発生率はプラセボ群と同様でした。
15歳以上の通年性アレルギー性鼻炎患者
この製品の安全性を評価するために、15歳以上の通年性アレルギー性鼻炎の成人患者3,235人を対象に、6週間のプラセボ対照臨床試験を2回実施しました。この製品の毎日の使用は忍容性が高く、副作用の発生率はプラセボ群と同様であり、季節性アレルギー性鼻炎の臨床研究と一致していました。両方の臨床研究で、有害事象の発生率は治療群で1%未満であり、薬物関連の事象は見られず、プラセボ群の有害事象よりも高かった。嗜眠の発生率はプラセボ群と同様でした。
臨床診療の複合分析
41のプラセボ対照臨床研究(15歳以上の患者に関する35の研究; 6-14歳の子供のための6つの研究)のプール分析は、効果的な自殺行動評価を使用して行われました。この製品を服用している9929人の患者とプラセボを服用している7780人の患者のうち、自殺念慮のある患者1人がこの製品を服用しました。どのグループでも、自殺、自殺未遂、自殺行動を完了するための準備行動はありませんでした。
46のプラセボ対照臨床試験(3ヶ月から14歳までの子供のための15歳以上の雄弁な11歳の研究のための35の研究)について、行動関連の有害事象を評価するために独立した複合分析が行われました。行動関連の有害事象の発生率は、この製品を11,673で服用した患者およびプラセボを投与された8827患者で2.73%および2.27%でした;オッズ比は1.12(95 CI [0.93; 1.36])でした。
これらの複合分析に含まれる臨床試験には、特定の設計自殺率や行動関連の有害事象はありませんでした。
市販後の経験
この製品には、使用後に次の副作用報告があります。
感染および感染:上気道感染。
血液およびリンパ系障害:出血傾向の増加。
免疫系障害:アレルギー反応を含む過敏症反応、非常にまれな肝好酸球浸潤。
精神系障害:攻撃的な行動または敵対的な興奮、不安、抑うつ、方向知覚の喪失、不注意、夜の夢、幻覚、不眠症、記憶障害、運動亢進(過敏性、落ち着きのなさを含む)を含むそして振戦)、夢遊病、自殺念慮と行動(自殺)。
神経系障害:めまい、嗜眠、知覚異常/触覚、非常にまれな発作。
心臓障害:動pal。
呼吸器、胸部および縦隔の障害:鼻汁;肺好酸球増加。
胃腸障害:下痢、消化不良、吐き気、嘔吐。
肝胆道障害:ALTおよびASTの上昇、非常にまれな肝炎(胆汁うっ滞、肝細胞、混合肝障害を含む)。
皮膚および皮下組織障害:血管浮腫、,傷、多形性紅斑、結節性紅斑、かゆみ、発疹、,麻疹。
筋骨格および結合組織障害:関節痛、筋肉のけいれんを含む筋肉痛。
その他の障害および投与部位:脱力/疲労、浮腫、発熱。
[禁忌]この製品の成分のいずれかにアレルギーがあることは禁じられています。
【注意事項】
急性喘息発作の治療における本製品の経口投与の有効性は確認されていません。したがって、急性喘息発作の治療には使用しないでください。
吸入グルココルチコイドの投与量は医師の指導の下で徐々に減らすことができますが、この製品は吸入グルココルチコイドまたは経口グルココルチコイドを突然置き換えるためには使用されません。
この製品を服用している患者は、神経学的事象を報告しています(副作用を参照)。他の要因もこれらのイベントを引き起こす可能性があるため、この製品に関連しているかどうかを確認することはできません。医師はこれらの有害事象について患者や介護者と話し合う必要があります。患者および/または介護者は、これらの状態が発生した場合、医師に通知する必要があることを通知する必要があります。
ロイコトリエン受容体拮抗薬などの抗喘息薬を服用している患者では、全身性グルココルチコイドの投与量を減らすと、以下の1つ以上のケースで発生するケースはほとんどありません:好酸球増加症、血管発疹、肺症状の悪化、心臓の合併症および/または神経障害(全身性好酸球性血管炎であるチャーグ・ストラウス症候群と診断されることもあります)。これらの症状とロイコトリエン受容体拮抗薬との因果関係は確定していませんが、この製品を受けている患者の全身のグルココルチコイドの投与量を減らすときは、適切な臨床モニタリングに注意を払うことをお勧めします。
[妊娠中の女性と授乳中の女性]
研究データのない妊婦の場合、薬を服用することが明示的に求められていない限り、妊婦はこの製品を服用しないでください。
グローバルマーケティング後の経験は、妊娠中にこの製品を使用した後、新生児の先天性四肢欠損のまれな報告があることを示しています。これらの女性のほとんどは、妊娠中に他の喘息治療も使用しています。この製品の使用とこれらのイベントとの因果関係は確立されていません。
この製品が牛乳から分泌されるかどうかは明らかではありません。多くの薬物はミルクから分泌される可能性があるため、授乳中の女性はこの製品を注意して使用する必要があります。
[子供の薬]
15〜18歳の患者については、[使用量と投与量]を参照してください。研究は、この製品が子供の成長率に影響を与えないことを示しました。この製品仕様は、15歳未満の子供には適していません。
[老人用]臨床研究では、この製品の有効性と安全性に年齢の違いはありません。
[薬物相互作用]
この製品は、喘息の予防と長期治療、およびアレルギー性鼻炎の治療に一般的に使用される他の薬剤と組み合わせることができます。薬物相互作用研究では、この製品の推奨用量は、次の薬物に対して臨床的に有意な薬物動態効果を持ちません:テオフィリン、プレドニゾン、プレドニゾロン、経口避妊薬(エチニルエストラジオール/ノルエチステロン) 35/1)、テルフェナジン、ジゴキシン、ワルファリン。
フェノバルビタール併用患者では、モンテルカストの血漿濃度-時間曲線下面積(AUC)は約40%減少しました。ただし、この製品の投与量を調整することはお勧めできません。
In vitro試験では、モンテルカストがCYP2C8の阻害剤であることが示されています。ただし、モンテルカストとロシグリタゾン、CYP2C8によって主に代謝される典型的なプローブ基質との間の薬物相互作用の臨床研究は、モンテルカストがin vivoでCYP2C8を阻害しないことを示唆しています。したがって、モンテルカストは、この酵素によって代謝される薬物(パクリタキセル、ロシグリタゾン、レパグリニドなど)には影響しないと考えられています。
【薬物の過剰摂取】
臨床治療におけるこの製品の過剰摂取に関する特定の情報はありません。慢性喘息の研究では、成人患者は22週間、1日あたり最大200 mgの用量を使用し、短期試験で使用された用量は約1週間、1日あたり900 mgでした。臨床的に重大な有害事象は発生しませんでした。
この製品を使用したマーケティングおよび臨床研究の後、急性薬物過剰摂取の報告がありました。これには、大人と子供の最大1000 mgの用量のレポートが含まれます。臨床および検査所見は、成人患者と小児患者の両方で一貫して安全性を示しています。薬物過剰摂取のほとんどの報告では、有害事象はありませんでした。最も一般的な有害事象は、腹痛、嗜眠、のどの渇き、頭痛、嘔吐、運動亢進などの安全機能と一致しています。
この製品が腹膜または血液透析によって除去できるかどうかは明らかではありません。
【薬理学と毒性学】
薬理学
モンテルカストナトリウムは、喘息の炎症を大幅に改善する強力な経口製剤です。生化学的および薬理学的バイオアッセイにより、モンテルカストはI型システイニルロイコトリエン(CysLT1)受容体(他の薬理学的に重要な気道受容体)に対して高い親和性と選択性を示しますプロスタグランジン、コリン作動性およびβアドレナリン受容体など)。モンテルカストは、LTC4、LTD4およびLTE4がCysLT1受容体に結合することによって生じる生理作用を、受容体アゴニスト活性なしで効果的に阻害できます。現在の研究では、モンテルカストはCysLT2受容体に拮抗しないことが示唆されています。
毒性学
反復投与毒性:サルおよびマウスの14週間毒性試験で、サルおよびラットはモンテルカストナトリウムに対して良好な耐性を示しました。試験したいずれかの動物にモンテルカストナトリウムの推奨用量の少なくとも125倍のヒト推奨用量を少なくとも使用した場合、毒性指標に対する毒性効果は認められなかった。
遺伝毒性:モンテルカストナトリウムは遺伝毒性および変異原性があるとは判明していません。 In vitro微生物突然変異試験およびV-79哺乳類細胞突然変異試験では、代謝活性の有無でモンテルカストナトリウムは陰性でした。ラット肝細胞アルカリ溶出試験およびin vitroでのチャイニーズハムスター卵巣細胞染色体異常試験では、ミクロソーム酵素活性システムの有無にかかわらず遺伝毒性効果はありませんでした。同様に、オスまたはメスのマウスに最大1200 mg / kg(3600 mg / m2)(成人の推奨1日用量の6000倍、成人体重50 kg)のモンテルカストナトリウムを経口投与した場合、骨髄細胞に染色体異常は誘発されませんでした。役割。
生殖毒性:雄ラットでは、経口モンテルカストナトリウムの投与量は800 mg / kg /日と高く、雌ラットの経口投与量は100 mg / kg /日と高かったが、受胎能および受胎能への影響は認められなかった。これらの用量は、成人の推奨用量(成人の体重50 kgに基づく)のそれぞれ4000および500倍です。
発生毒性試験では、投与量が400 mg / kg /日と高い場合、およびモンテルカストナトリウムの投与量がウサギで100 mg / kg /日と高い場合、ラットに治療に関連する悪影響は認められなかった。実際、ラットおよびウサギでは胎児がモンテルカストナトリウムに暴露され、授乳中のラットの乳汁中にモンテルカストナトリウムが明らかに検出された場合がありました。
発がん性:ラットで106週間の最大200 mg / kg / dayの経口投与とマウスで92週間の最大100 mg / kg / dayの経口投与の研究では、モンテルカストナトリウムの臨床的有効性は発がん性であることが判明していません。これらの用量は、成人の推奨用量の1000倍と500倍に相当します(成人の体重50 kgに基づく)。
[薬物動態]
吸収する
モンテルカストの経口吸収は迅速かつ完全です。空の胃でフィルムコーティング錠剤10mgを摂取した後、血漿濃度は3時間(Tmax)でピーク濃度(Cmax)に達しました。平均経口バイオアベイラビリティは64%でした。通常の食事は、経口バイオアベイラビリティとCmaxに影響しません。臨床研究では、モンテルカストナトリウムは、食後いつでも10mgのフィルムコーティング錠を服用することが、安全で効果的であることが示されています。
配布
モンテルカストナトリウムの99%以上が血漿タンパク質に結合します。モンテルカストの定常状態の分配量は、平均で8〜11リットルです。ラットの同位体標識モンテルカストの研究では、ごく少量のモンテルカストのみが血液脳関門を通過することが示されています。さらに、他のすべての組織における放射性標識の量は、投与後24時間で非常に少なかった。
代謝
モンテルカストはほぼ完全に代謝されます。治療用量を使用した研究では、モンテルカストの代謝物は、成人および小児の定常状態で血漿中に検出されませんでした。
in vitroでヒト肝ミクロソームを使用した研究により、シトクロムP450 3A4および2C9がモンテルカストの代謝に関与していることが示されました。 in vitroでのヒト肝ミクロソームのさらなる研究によると、モンテルカスト治療用量の血漿濃度は、チトクロームP450 3A4、2C9、1A2、2A6、2C19または2D6を阻害しません。
排泄
健康な成人におけるモンテルカストの平均血漿クリアランスは45 ml /分でした。経口同位体標識モンテルカスト後、放射能の86%が次の5日間に収集された糞で検出され、尿で測定された量は<0.2%でした。モンテルカストの経口バイオアベイラビリティと組み合わせて、モンテルカストとその代謝物は、ほぼ排他的に胆汁を介して排泄されます。
健康な若者を対象に実施された多くの研究では、モンテルカストの平均血漿中半減期は2.7〜5.5時間であることが示されています。モンテルカストの薬物動態は、最大50 mgの経口用量の範囲で線形関係に近似しています。朝と夜のモンテルカスト服用の薬物動態に違いはありませんでした。モンテルカスト10 mgを1日1回服用すると、元の薬物が血漿にわずかに蓄積されました(約14%)。
特別な患者
高齢者、腎不全患者、または軽度から中等度の肝不全患者の用量を調整する必要はありません。モンテルカストに関する臨床データは、重度の肝機能不全の患者では利用できませんでした(Child-Pughスコア> 9)。
[保管]遮光し、密閉して、涼しい場所(20°C以下)で保管してください。
[パッキング]ダブルアルミニウムパッケージ。 6個/箱、12個/箱、18個/箱、24個/箱。
[有効期間] 36か月。
[実行基準]国立食品医薬品局標準YBH04912008
[承認番号] Guoyao Zhunzi H20083372
[メーカー]
会社名:Lunan Beite Pharmaceutical Co.、Ltd.
生産住所:山東省臨y市銀que山路243号
郵便番号:276006
電話番号:0539-8336336(販売)8336337(品質管理部)
FAX番号:0539-8336029(販売)8336338(品質管理部)
ウェブサイト:www.lunan.com.cn
24時間対応のカスタマーサービスホットライン:400-0539-310