ラタノプロスト点眼薬
適応症
開放隅角緑内障と高眼圧症の患者に眼圧を下げるのに適しており、他の有害な眼圧薬や効能の低下に耐えることができません(複数回測定しても目標の眼圧低下基準を満たせません)。
臨床薬理学
ラタノプロストは、選択的F2a受容体アゴニストである新規のフェニル置換プロピルエステルプロスタグランジンF2aです。 この製品は、イソプロピルエステルの形態の前提薬です。 角膜を通して吸収され、エステラーゼの作用により生物学的に活性な遊離酸に加水分解され、房水の強膜色素流出を増加させて眼圧を低下させます。 この製品はまた、緑内障患者が通常眼球骨梁構造スクリーンをブロックするようにします。
使用量と投与量
点眼薬は、1日に1回、1滴ずつ、夜に点眼するのが最善です。
処方
目薬
仕様書
2.5 ml:0.125 mg。
取扱説明書
承認日:2007年5月16日
変更日:

ラタノプロスト点眼薬の指示
指示を注意深く読み、医師の指導の下で承認日を使用してください。
[薬の名前]
一般名:ラタノプロスト点眼薬
英語名: Latanoprost Eye Drops
中国語ピンイン: Latanqianliesu Diyanye
[成分]ラタノプロスト。
化学名:Z-7-[(1R、2R、3R、5S)-3,5-ジヒドロキシ-2-[(3R)-3-ヒドロキシ-5-フェニルペンチル]シクロペンチル] -5- イソ酪酸イソプロピルエステル。
化学構造:
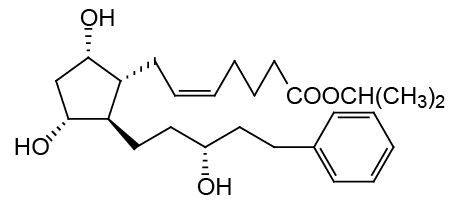
分子式:C26H40O5
分子量:432.58
【特性】本製品は無色またはほぼ無色透明の液体です。
[適応]
開放隅角緑内障と高眼圧症の患者に眼圧を下げるのに適しており、他の有害な眼圧薬や効能の低下に耐えることができません(複数回測定しても目標の眼圧低下基準を満たせません)。
[仕様] 2.5ml:0.125mg。
[用法と用量]点眼薬は、1日に1回、1滴ずつ、夜に点眼するのが最適です。
【副作用】
この製品は、通常、忍容性が高く、ときどき視力障害、burning熱痛、刺痛、結膜充血、一過性の角膜びらん、異物感があります。まつ毛の変化(長さ、密度、色、方向)、まぶたの黒ずみ、虹彩の茶色の色素沈着(6ヵ月後7%、12ヵ月後16%)も経験する患者もいます。色素沈着の増加は、緑茶色、青茶色茶色、または黄茶色の虹彩を持つ人々でより一般的であり、純粋な青、青灰色、または緑の虹彩の人々ではまれです。これはメラニン形成の刺激によって引き起こされ、薬物の停止後に進行を停止できますが、色素沈着を元に戻すことはできません。
[タブー]
高感度ラタノプロスト、塩化ベンザルコニウム、および製剤中のその他の成分は禁止されています。
妊娠中、授乳中、重度の喘息の患者、または炎症性および充血性の眼の期間中の患者は禁止されています。
【注意事項】
1この製品は色素沈着の変化を引き起こす可能性があります。最も頻繁に報告される変化は、虹彩とまぶたの色素沈着を増加させること、色素沈着とまつげの成長を増加させることです。これらの変化は永続的です。
2妊娠中、授乳中、重度の喘息または目の中の炎症性の目、患者は禁止されています。子供はお勧めしません。
3この製品は、閉塞隅角または先天性緑内障、色素性緑内障、仮性緑内障の開放隅角緑内障の治療には適していません。
4この製品は、他の緑内障治療薬との相乗効果があります。
5コンタクトレンズを着用すると、最初にレンズを取り外し、レンズを着用する前に15分間薬を滴下する必要があります。
6薬の服用を忘れた場合は、考えたときにすぐに使用する必要があります。
[妊婦および授乳中の女性]妊娠、授乳中の女性は禁止されています。
[子供用医薬品]この実験は実施されておらず、信頼できる基準はありません。
[老人用]安全性と有効性は成人と変わらず、臨床用量で使用できます。
[薬物相互作用]
この製品は、他の緑内障治療薬との相乗効果があります。
【薬物の過剰摂取】
過剰摂取、眼刺激、結膜および周辺組織の浮腫に加えて、残りは明確ではありません。薬物が過剰摂取であることがわかった場合、病気に対処します。
【薬理学と毒性学】
作用機序:ラタノプロストは、選択的F2a受容体アゴニストである新規フェニル置換プロピルエステルプロスタグランジンF2aです。この製品は、イソプロピルエステルの形態の前提薬です。角膜を通して吸収され、エステラーゼの作用により加水分解されて生物学的に活性な遊離酸になり、房水の強膜色素流出を増加させて眼圧を低下させます。この製品はまた、緑内障患者が通常眼球骨梁構造スクリーンをブロックするようにします。
発がん性、変異原性、および生存:この製品には、細菌、マウスリンパ腫細胞、および小核試験における変異原性の影響はありません。
ヒトリンパ球実験では、製品に染色体異常があります。
マウスとラットに20〜24か月間、170μg/ kg / d(人間が使用する場合の最大用量の約2800倍)を経口投与しましたが、発がん作用は観察されませんでした。
ラットのin vivoおよびin vitro研究では、この製品がDNA合成に干渉しないことが示されていますが、動物研究では、この製品が雄および雌の生存に影響しないことが示されています。
催奇形性効果:ウサギの妊娠試験により、この製品の量が人体の最大投与量の80倍になると、4/16のメスのウサギが死産することが示されました。この研究は、適切なコントロールが不足しているため、妊婦では実施されませんでした。妊娠中の女性は、この製品を使用する場合の長所と短所を比較検討する必要があります。
[薬物動態]
この製品は角膜内で遊離酸に加水分解され、この遊離酸は角膜から拡散して房水に入り、約2時間で血液のピークに達します。 3〜4時間後、眼圧は低下し始め、8〜12時間で最大の低下に達し、24時間後に眼圧は増加しませんでした。薬物は流出すると排出され、半減期は約2時間です。全身吸収は結膜または粘膜から生じ、吸収された薬物は主に血液循環系に排泄され、主に肝臓で代謝された後尿に排泄されます。
[保管]開く前に2°Cから8°Cで保管し、遮光してください。開封後、室温25℃未満で保存できます。
[包装]ペットボトル、1本/箱。
[有効期間]暫定的に24か月。
[実行基準]国立食品医薬品局の国立医薬品基準YBH09872004。
[承認番号] National Drug Standard H20044234。
[メーカー]
会社名:Lunan Beite Pharmaceutical Co.、Ltd.
生産住所:山東省臨y市銀que山路243号
郵便番号:276006
電話番号:0539-8336336(販売)0539-8336337(品質パイプ部門)
ファックス番号:0539-8336029(販売)0539-8336338(品質パイプ部門)
ウェブサイト:www.LUNAN.com.cn
24時間対応のカスタマーサービスホットライン:400-0539-310

